Bu yazı, astrositik tümörlerin infiltratif/diffüz alt tiplerinin moleküler sınıflandırmasına odaklanmaktadır.
Giriş: Astrositik tümörler, erişkinlerde en sık rastlanan primer beyin tümörleri arasında yer alır. Astrositomlar ve glioblastomlar infiltratif büyüme özellikleri nedeniyle tedavi açısından zordur ve yüksek mortaliteye sahiptir. Geleneksel histopatolojik sınıflandırma tekniği tek başına prognozu tam yansıtmayabilir; bu nedenle son yıllarda moleküler belirteçlerin önemi öne çıkmıştır. 2016 WHO’nun ardından yayımlanan WHO 2021 (CNS5) sınıflandırması, moleküler alt tipleri birincil tanı kriteri olarak benimsemiş ve tanıda IDH mutasyonları başta olmak üzere çeşitli genetik belirteçleri esas almıştır. Bu yaklaşım, sınıflandırma doğruluğunu artırmış ve tedavi kararlarını moleküler alt tiplere göre yönlendirmede kritik rol oynamıştır.
WHO 2021’e Göre Astrositik Tümör Sınıflandırması
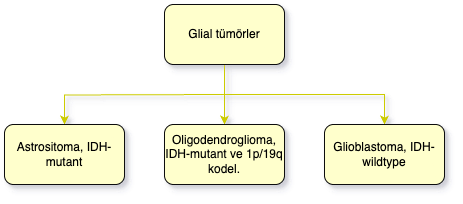
WHO 2021 sınıflandırması, erişkin tip Glial tümörlerini üç ana kategoriye ayırır: “Astrositoma, IDH-mutant”; “Oligodendroglioma, IDH-mutant ve 1p/19q kodel.”; ve “Glioblastoma, IDH-wildtype”. Eskiden ayrı tümör tipleri olarak sınıflandırılan IDH-mutant astrositik tümörler, tek bir tümör tipi (Astrositoma, IDH-mutant) altında toplanmış ve WHO dereceleri (2, 3 veya 4) moleküler bulgulara göre verilmiştir. Örneğin, homozigot CDKN2A/B delesyonu varlığı, hastanın mikrovasküler proliferasyon veya nekroz göstermese bile tümörü otomatik olarak Grade IV olarak derecelendirir.
IDH-wildtype (IDHwt) astrositomlar ise erişkinlerde, genetik özelliklerinden biri veya birkaçı mevcutsa glioblastoma olarak kabul edilir. Yeni kural olarak IDHwt gliomlarda EGFR amplifikasyonu, TERT promotor mutasyonu veya kromozom +7/-10 değişikliği varlığı, tümörün glioblastoma, IDH-wildtype (WHO G4) olarak sınıflanması için yeterlidir. Bu nedenle mikroskopik olarak düşük dereceli görünen bir IDHwt astrositik tümörde bu moleküler değişikliklerden biri saptanırsa, glioblastoma tanısı konur.
Tablo 1’de başlıca astrositik tümör tipleri ve karakteristik moleküler özellikleri özetlenmiştir. Örneğin, Astrositoma, IDH-mutant tümörleri sıklıkla IDH1/2 mutasyonu, ATRX kaybı ve TP53 mutasyonu taşır; Oligodendroglioma ise 1p/19q kodelasyonu ve TERT promotor mutasyonu içerir. Pilocytic astrositom gibi sınırlı (WHO G1) tümörlerde ise KIAA1549-BRAF füzyonları görülür.
| Tümör tipi (WHO 2021) | WHO Derecesi | Temel moleküler belirteçler |
|---|---|---|
| Astrositoma, IDH-mutant (astrositoma) | G2-4 | IDH1/2 mutasyonu; ATRX kaybı; TP53 mutasyonu; CDKN2A/B homozigot delesyon (G4) |
| Oligodendroglioma, IDH-mutant + 1p/19q kod. | G2-3 | IDH1/2 mutasyonu; 1p/19q kodelasyonu; TERT promotor mutasyonu; CIC, FUBP1 mutasyonları |
| Glioblastoma, IDH-wildtype | G4 | IDH-wt; TERT promotor mutasyonu; EGFR amplifikasyonu; +7/-10 kromozomal değişiklikleri |
| Pilositik astrositom | G1 | KIAA1549-BRAF füzyonu; diğer BRAF mutasyonları; NF1 mutasyonu |
| Plezmorfik ksantoastrositom (PXA) | G2 (nadiren G3) | BRAF V600E mutasyonu; CDKN2A/B delesyonu |
| Yüksek dereceli piloid astrositom (HGAP) | G3 | BRAF mutasyonu; NF1 mutasyonu; ATRX mutasyonu; CDKN2A/B delesyonu |
Temel Moleküler Belirteçler
- IDH1/2 mutasyonları: Gliomların sınıflandırmasında merkezi önemdedir. IDH mutasyonları genellikle genç hastalarda görülür ve belirgin bir prognostik üstünlüğe sahipti. Gerçekten de IDH-mutant glial tümörlerin median sağkalımı, IDH-wildtype’e kıyasla anlamlı derecede yüksektir. Örneğin yeni çalışmalarda IDH-mutant Grade II astrositom veya oligodendrogliom olgularında IDH inhibitörleri (ivosidenib, vorasidenib) ciddi PFS uzaması sağlamış ve FDA onayı almıştır. Bu nedenle IDH durumu hem tanısal hem de tedavi yönünden kritiktir.
- ATRX mutasyonu/kayıpları: ATRX geni genellikle IDH-mutant astrositomalarda inaktiftir. ATRX proteininin kaybı, IDH-mutant oligoastrositom ayrımı için kullanılabilir ve 1p/19q testi yapılamıyorsa astrocytoma lehine bir gösterge sayılır. Tersine, oligodendrogliomlarda ATRX genellikle korunduğundan ATRX kaybı astrocytoma tanısını güçlendirir.
- TP53 mutasyonu: TP53 tümör supressör gen mutasyonları, özellikle IDH-mutant astrositomalarda sık rastlanan başka bir belirteçtir. TP53 mutasyonu hücre döngüsü kontrolünün bozulmasına yol açarak tümör progresyonunu hızlandırır. Örneğin IDH-mutant astrositomalarda TP53’ün özellikle R273C hot-spot mutasyonu %20–30 oranında görülmüş ve bu mutasyona sahip tümörler diğerlerinden daha kötü sağkalım göstermiştir. Genel olarak TP53 mutasyonu, IDH-mutant astrocytoma biyolojisinde önemli rol oynar.
- CDKN2A/B deletions: CDKN2A ve CDKN2B tümör baskılayıcı genlerinin homozigot kaybı, 2021 WHO’ya göre IDH-mutant astrositomları Grade IV’a yükselten en önemli moleküler kriterlerden biridir. Yani bu delesyon varlığında tümör ne kadar histolojik olarak düşük dereceli görünse de yüksek dereceli kabul edilir. CDKN2A/B deleteleri ayrıca kötü prognoz ile ilişkilidir. Son yayınlar, CDKN2A mutasyonu veya delesyonunun, tümör progresyonunu hızlandırıp progresyonsuz ve genel sağkalımı anlamlı düşürdüğünü göstermiştir.
- MGMT promotor metilasyonu: Glioblastomlarda temozolomid tedavisine yanıtın en kuvvetli belirleyicisidir. MGMT metilasyonu varlığı, DNA onarım enzimi ekspresyonunu azaltarak alkilleyici kemoterapinin etkisini artırır. Metileli GB’de (Glioblastom) ortanca sağkalım ~24,6 ay iken, metilsiz GB’de bu süre ~14,1 ay olarak bildirilmiştir. Bu nedenle MGMT metilasyon durumu, hem hastaların prognozunu etkileyen hem de tedavi şeması seçiminde yol gösteren bir öngörücü belirteçtir.
- EGFR amplifikasyonu: Epidermal büyüme faktörü reseptör gen amplifikasyonu, IDH-wildtype glioblastomlarda çok sık (%50 civarında) görülür. Bu değişiklik, tümör büyümesi ve tedaviye dirençle ilişkilidir. Ne var ki, GB’de EGFR amplifikasyonu hedefli birçok moleküler terapötik denemesine rağmen şimdiye kadar anlamlı klinik yanıt alınamamıştır.
- TERT promotor mutasyonu: TERT geninin promotor bölgesindeki mutasyonlar, IDH-wildtype GB ve oligodendrogliomlarda çok sık (%70–80) saptanır. Bu mutasyonlar tümör hücrelerinde telomeraz aktivasyonunu sağlayarak maligniteyi destekler. WHO CNS5’e göre TERT mutasyonu EGFR ve +7/-10 ile birlikte IDH-wildtype bir glioma varsa tanının glioblastom IDH-wt olmasını sağlar. IDH-mutant astrositomalarda ise TERT mutasyonu nadirdir.
- Diğer olası belirteçler (BRAF, NF1 vb.): Bazı astrositik tümörler için diğer genetik alterasyonlar önemlidir. Örneğin BRAF V600E mutasyonu, plezmorfik ksantoastrositomların yarısında olmak üzere gangliogliomlarda, pilositik astrositomlarda ve glioblastomlarda görülebilir. BRAF füzyonları (ör. KIAA1549-BRAF) çoğunlukla pilositik astrositomlarda tanımlanmıştır. NF1 gen mutasyonları ise genellikle pediatrik veya juvenil tip gliomlarla ilişkilidir ve nadiren erişkin mesenkimal alt tip GB’de tanımlanmıştır. Bu belirteçlerin varlığı, özellikle hedeflenebilir moleküler tedaviler için önemlidir.
Moleküler Belirteçlerin Prognostik ve Prediktif Değeri
Moleküler profil, astroglial tümörlerde hastalık seyrini öngörmede kritiktir. Genel olarak IDH-mutant astrositomlar, IDH-wildtype versiyonlara göre daha iyi prognoza sahiptir. Benzer şekilde MGMT promotor metilasyonu olan GB’lerde ortanca sağkalım anlamlı uzarken, CDKN2A/B delesyonu varlığı IDH-mutant tümörlerde kötü prognoz ile ilişkilendirilmiştir. TERT mutasyonu tek başına oligodendrogliom veya GB altgruplarında anlamlı bir prognostik faktör olarak kabul edilmese de, bu genlerin kombinasyonu tümörün kimliğini ve agresifliğini belirler. TP53 veya ATRX mutasyonları ise daha çok tümör tanımlaması açısından değer taşır.
Öte yandan bazı belirteçler tedavi yanıtını öngörmede prediktiftir. MGMT metilasyonu, temozolomid duyarlılığı için güçlü bir göstergedir. Aynı şekilde, tümör IDH-mutasyonlu ise yakın gelecekte onay almış IDH inhibitörleri (ivosidenib/vorasidenib) ile tedavi imkânı doğabilir. BRAF V600E varlığı, BRAF/MEK inhibitörleriyle iyi yanıt alma şansını artırır. NTRK füzyonları çok nadir olmakla birlikte, saptandığında larotrectinib/entrectinib gibi tümöre özgü onaylı ajanlarla yüksek oranda cevap alınabilmektedir. Öte yandan EGFR amplifikasyonu GB için belirgin prognostik kötü gösterge olsa da güncel çalışmalar EGFR hedefli tedavilerin yaşam süresini anlamlı düzeyde uzatamadığını göstermiştir. Yine de moleküler belirteçlerin varlığı tedavi planını şekillendirmede giderek artan bir rol üstlenmektedir.
Moleküler Alt Tiplere Göre Tedavi Yaklaşımı ve Güncel Araştırmalar
Moleküler alt türe göre kişiselleştirilmiş tedavi stratejileri geliştirilmektedir. IDH-mutant astrositomlar genellikle genç hastalarda görülür ve nispeten yavaş seyirlidir. Standart tedavi cerrahi + radyoterapi (+/- kemoterapi) olsa da, rekürren veya ileri evre olgularda IDH inhibitörleri (ivosidenib/vorasidenib) kullanımı gündemdedir. Vorasidenib, Grade II IDH-mut gliomlarda PFS’yi iki katına çıkarmış ve Ağustos 2024’te FDA onayı almıştır. Bunun yanı sıra oligodendrogliomlarda 1p/19q kodelasyonu varlığı PCV (prokarbazin-lomustin-vinkristin) kemoterapisinden veya TMZ kemoterapisinden belirgin yarar sağladığı için tedavi protokollerine yön verir.
IDH-wildtype glioblastomlarda, standart şema maks. rezeksiyon + radyoterapi + temozolomid (Stupp protokolü) olarak kabul edilir. MGMT metilsiz yaşlı hastalarda kemoterapi kesilebilirken, metilli hastalar temozolomide iyi yanıt verir. Yenilikçi yaklaşımlar arasında TTFields (tümör yıkıcı alanlar) ve hedefe yönelik denemeler bulunur. Örneğin, BRAF V600E+ glioblastomlarda dabrafenib+trametinib kombinasyonu kullanılmıştır. BRAF V600E mutasyonu taşıyan pediyatrik veya PXA olgularında bu tedaviye %30–70 arası yanıt alındığı rapor edilmiştir.
İmmünoterapi (anti-PD1) araştırmaları GB’de umut vaat edici sonuç vermemiştir; CheckMate 548 ve 498 gibi çalışmalarda nivolumab ile sağkalım artışı sağlanamamıştır. Özetle, güncel klinik araştırmalar moleküler alt tipleri hedefleyen ajanlar (IDH/BRAF inhibitörleri, akıllı kemoterapiler vb.) üzerine yoğunlaşmakta, ancak GB’de hala cerrahi-radyoterapi-temozolomid kombinasyonu temel tedavi olarak kalmaktadır.
Moleküler Sınıflandırmanın Patolojik Sınıflamaya Katkısı ve Sınırları
Moleküler veriler, patolojik tanıda objektiflik ve tutarlılık sağlamıştır. WHO CNS5, IDH mutasyonu gibi moleküler belirteçlere dayalı daha az sayıda tümör tipi tanımlayarak önceki sınıflandırmanın karmaşıklığını azaltmıştır. Örneğin eskiden “oligoastrositom” gibi karışık lezyonlar NOS kabul edilirken, yeni kriterlerle bu tümörler artık kesin olarak astrocytoma veya oligodendroglioma olarak sınıflandırılır. Ayrıca ATRX, p53 immünositokimyası gibi ikincil analizler, moleküler test yapılamayan durumlarda bile astroglial alt tip tayinine olanak sağlar.
Buna karşın kısıtlamalar da vardır. Moleküler tanı için doku miktarı, maliyet ve laboratuvar altyapısı gereksinimi sınırlayıcı olabilir. Tümör içi heterojenite, bazı alt tiplerin karışık moleküler profillere sahip olmasını sağlayabilir. Ayrıca WHO 5. edisyonu halen sınırlı sayıda genetik değişikliği temel alır; gelecek yıllarda yeni işaretçiler eklenebilir. Yine de WHO CNS5’te moleküler sınıflandırma sayesinde tedavi ve prognostik öngörüler belirgin şekilde iyileşmiş olup, tanıya objektif kriterler kazandırılmıştır.
Sonuç: Astrositik tümörlerin modern sınıflandırması, moleküler genetik bilgilere dayanmaktadır ve bu sayede tanı, prognoz ve tedavi yönünden daha kesin kriterler sunmaktadır. IDH, ATRX, TP53, CDKN2A/B gibi belirteçler artık tanısal alt tiplerin ayrımında zorunlu hale gelmiştir. Bu yaklaşım, heterojen gliomların anlaşılmasında devrim niteliği taşımış, moleküler alt tipleri hedefleyen yeni tedavi stratejilerinin geliştirilmesine zemin hazırlamıştır.
Kaynakça
- Louis, D. N., Perry, A., Wesseling, P., Brat, D. J., Cree, I. A., Figarella-Branger, D., … & Ellison, D. W. (2021). The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica, 23(8):1231-1251, DOI: 10.1093/neuonc/noab106 PubMed: PMID: 34185076 PMCID: PMC8328013
- Mellinghoff, I. K., Ellingson, B. M., Touat, M., et al. (2023). Vorasidenib in IDH1- or IDH2-mutant low-grade glioma. New England Journal of Medicine, 2023 Aug 17;389(7):589-601. doi: 10.1056/NEJMoa2304194. PubMed: PMC11445763 PMID: 37272516
- Zacher, A., Kaulich, K., Stepanow, S., et al. (2022). Molecular diagnostics of gliomas: state of the art. Cancers (Basel), 14(5), 1117. DOI: 10.1007/s00401-010-0736-4 PubMed: https://pubmed.ncbi.nlm.nih.gov/20714900/ PMID: 20714900 PMCID: PMC2955236
- Wen, P. Y., Weller, M., Lee, E. Q., et al. (2020). Glioblastoma in adults: a Society for Neuro-Oncology and European Society of Neuro-Oncology consensus review. Neuro-Oncology, 22(8), 1073–1113. DOI: 10.1093/neuonc/noaa106 PubMed: PMID: 32539188 PMCID: PMC7387087
- Ceccarelli, M., Barthel, F. P., Malta, T. M., et al. (2016). Molecular profiling reveals biologically discrete subsets and pathways of progression in diffuse glioma. Cell, 164(3), 550–563. DOI: 10.1016/j.cell.2015.12.028 PubMed: PMID: 26824661 PMCID: PMC4754116
- Stupp, R., Mason, W. P., van den Bent, M. J., et al. (2005). Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine, 352(10), 987–996. DOI: 10.1056/NEJMoa043330 PubMed: PMID: 15758009
- Brennan, C. W., Verhaak, R. G. W., McKenna, A., et al. (2013). The somatic genomic landscape of glioblastoma. Cell, 155(2), 462–477. DOI: 10.1016/j.cell.2013.09.034 PubMed: PMID: 24120142 PMCID: PMC3910500
- Reuss, D. E., Sahm, F., Schrimpf, D., et al. (2015). ATRX and IDH1-R132H immunohistochemistry with subsequent copy number analysis and IDH sequencing: a practical approach. Acta Neuropathologica, 129(1), 133–146. DOI: 10.1007/s00401-014-1370-3
- The dominant TP53 hotspot mutation in IDH-mutant astrocytoma, R273C, has distinctive pathologic features and sex-specific prognostic implications. DOI: 10.1093/noajnl/vdab182 PMCID: PMC8760900 PMID: 35047821
- Vincenzo Di N., Lidia G., Alicia T., Stefania B., Enrico F.. Implications of BRAF V600E mutation in gliomas: Molecular considerations, prognostic value and treatment evolution. DOI: 10.3389/fonc.2022.1067252 PMCID: PMC9846085 PMID: 36686797
Bir yanıt yazın